▼
Jumat, 27 Maret 2020
MEKANISME REAKSI-REAKSI ADISI ALDEHID DAN KETON
MEKANISME REAKSI-REAKSI ADISI ALDEHID
DAN KETON
Gugus
karbonil merupakan gugus terpenting dalam kimia organik. Hampir setiap proses
sintesis memanfaatkan gugus karbonil.
Berikut ini
jenis- jenis senyawa karbonil
Pada kali
ini kita akan membahas mengenai mekanisme reaksi adisi aldehid dan keton. Pada
adisi nukleofilik dari aldehid dan keton biasanya memiliki dua variasi.
teermediet tetrahedral nantinya akan terprotonasi menghasilkan suatu alkohol
yang stabil, suatu atom oksigen karbonil berikutnya akan dilepaskan (sebagai
H2O atau OH -) untuk menghasilkan suatu ikatan rangkap karbon-nukleofil.
Aldehida
pada umumnya lebih reaktif dibanding keton dalam reaksi adisi nukleofilik
karena dua alasan, yaitu sterik dan elektronik.
Ada berbagai
macam reaksi adisi nukleofilik namun disini saya hanya menjelaskan hanya reaksi
3 saja yakni :
1. Reaksi
adisi nukleofil H2O atau sering disebut juga dengan reaksi adisi hidrasi yakni
pada reaksi ini membuat suatu gem-diol
atau hidrat. Bentuk umum dari rekasi adisi hidrasi ini adalah sebagai berikut:
Contohnya
jika menggunakan substratnya aldehid dan keton:
Pada reaksi
yang pertama keton (aseton) direaksikan dengan (H2O) akan
menghasilkan senyawa hidrat yakni aseton hidrat (0,1%). Dan pada reaksi kedua
aldehid (formaldehida) bereksi degan air akan membentuk senyawa hidrat yaitu formaldehida
hidrat (99,9%). Berikut ini mekanisme pada reaksi adisi nukleofil H2O:
Dapat dilihat
pada katalis basa nukleofil akan menyerang gugus karbonilnya sehingga ikatan
rangkap atau ikatan pi-nya terputus lalu mengikat nukleofil dan atom O menjadi
kekurangan elektron. Sehingga ion H+ yang berasal dari air akan terlepas dan
tertarik pada atom O yang memiliki kekurangan elektron. lalu akan menghasilkan
suatu senyawa hidrat dan –OH. dan ketika katalis asam akan menghasilkan suatu senyawa
hidrat dan H3O+.
2. Reaksi adisi Pereaksi Grignard.
2. Reaksi adisi Pereaksi Grignard.
Pada reaksi
ini akan membentuk senyawa alkohol. Pereaksi pada Grignard ini yakni nukleofil
karena pada ikatan karbon-magnesium sangat terpolarkan oleh kerapatan elektron
yang cukup tinggi pada karbon. Bentuk umum reaksi adisi dari pereaksi gridnard pada
keton atau aldehid ialah sebagai berikut:
Jika formal
dehid bereaksi oleh suatu pereaksi grignard maka yang akan dihasilkan adalah
alkohol primer, jika aldehid bereaksi oleh suatu pereaksi grignard maka yang
akan dihasilkan adalah alkohol sekunder dan jika keton bereaksi dengan suatu pereaksi
gridnard maka yang akan dihasilkan adalah alkohol tersier. Berikut ini
mekanisme umum reaksi adisi pereaksi grignard yang terjadi pada aldehid atau
keton:
Pada tahap yang
pertama yakni ionisasi gridnard dimana gridnard akan dipecahkan menjadi R:
bermuatan yang bermuatan negatif (-) dan MgX yang bermuatan positif (+). selanjutnya
R: yang bermuatan negatif akan tertarik ke gugus karbonil atau paad C
karbokation dan ikatan phi akan terputus sehingga atom O menjadi bermuatan
negatif (-). Tahap selanjutnya yakni O yang bermuatan negatif (-) yang berdampigan
dengan +MgX atau disebut tahap intermediat tetrahedral dapat disebut
juga senyawa organologam. Tahap selanjutnya adalah tahapan adisi hidrasi yakni
atom H+ akan tertarik ke arah atom O yang bermuatan negatif (-). Lalu OH-
mengikat +MgX sehingga dapat membentuk senyawa alkohol dan senyawa gridnard.
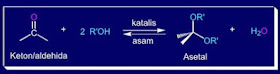
3. Adisi Nukleofilik dengan Alkohol.
3. Adisi Nukleofilik dengan Alkohol.
Pada reaksi
ini akan membentuk senyawa asetal. Alkohol merupakan salah satu contoh nukleofil
lemah yang dapat mengadisi keton atau aldehida dengan cukup lambat pada suasana
netral. Berikut ini merupakan bentuk umum reaksi adisi nukleofilik menggunakan
alkohol pada aldehid/keton:
Contoh :
Pada reaksi
diatas yakni 4-ters-Butilsikloheksanol direkasikan dengan alkohol primer yang akan
menghasilkan 4-ters-Butilsikloheksanol etilena asetal atau suatu asetal siklik.
Dalam suasana asam, oksigen karbonil yang merupakan nukleofilik akan mengalmi protonasi,
dan senyawa karbonil yang irprotonasi akan lebih reaktif dibandingkan suatu
senyawa karbonil yang netral. Mekanisme reaksi nukleofil oleh alkohol pada
aldehid atau keton dalm suasana asam ialah:
Pada
mekanisme ini pertma yakni protonasi H+ dimaan akan membentuk suatu gugus
karbonil atau C karboktion selanjutnya gugus karboinil terpolarsasi kuat dan
aktivitas gugus karbonil melakukan serangan nukleoflik oleh pasangan elktron
bebas dari alkohol lalu akan menghasilkan suatu sneyawa semi asetal
terprotonasi. selajutnya masuk ke tahap pelepasna akan menghasilkan intermedeit
tetrahedral hemiasetal netral. tahap selanjutnya yakni protonasi hidroksil
hemiasetal dengan mengubahnya menjadi gugus pergi atau "leaving
group" yang baik. Selanjutnya dehidrasi dari hemi aestal keprotonasi dapat
menghasilkan intermediet ion oksonium. Lalu diadisi oleh alkohol kedua sehingga
dapat menghasilkan asetal yang terprotonasi. Lalu pada tahap terakhir yakni tahap deprotonasi
atau tahap kehilangan proton yang mana akan menghasilkan suatu produk asetal.
Reaktivitas
relatif antara aldehida dan keton yang mana Aldehid pada umumnya lebih reaktif
dibanding keton dalam reaksi adisi nukleofilik dikarenakan adanya alasan sterik
dan elektronik.
Permasalahan
:
1.Apa
pengaruh sterik dan elektronik sehingga menyebabkan aldehid lebih reaktif dari
keton?
2. Apa Yang
menyebabkan alkohol mengadisi keton atau aldehid pada suasana netral
berlangsung lambat?
3.Ketika
alkohol mengadisi keton dan aldehid pada suasana netral berlangsung lambat
bagaimana jika pada suasana asam ?
Jumat, 20 Maret 2020
MEKANISME REAKSI BERSAING SN2 DAN E2
Minggu
lalu saya telah membahas mengenai mekanisme reaksi bersaing SN1 dan E1 ada baik
jika materi ini kita sambung denan mekanisme reaksi bersaing SN2 dan E2. Reaksi
bersaing antara substitusi dan eliminasi bimolekuler ini biasanya terjadi
karena akibat perbedaan kebasaan.
Derajat nukleofilitas dibandingkan dengan kebasaan bisa menentukan suatu jalan
reaksi. Nukleofilitas adalah kemampuan pereaksi dapat mengalami substitusi,
sedangkan kebasaan adalah kemampuan pereaksi dapat menerima proton.
Pada reaksi bersaing SN2 dan E2 suatu alkil
halida primer dengan suatu basa yang kuat akan mengalami reaksi
SN2 . Pada reaksi bersaing SN2 dan E2 cenderung menghasilkan produk SN2. Berbeda dengan alkil halide tersier, jila nukleofilnya merupakan
basa kuat maka akan mengalami reaksi E2.Pelarut ikut juga pengaruh pada reaksi
bersaing substitusi dan eliminasi bimolekuler ini. Pada reaksi SN2
dan E2 biasanya menggunakan pelarut polar bisa juga menggunakan pelarut yang
kurang polar, seperti aseton.
Adapula faktor yang
mempengaruhi reaksi bersaing antar SN2 dan E2 yakni konsentrasi dari
nukleofil. Konsentrasi nukleofil dapat mempengaruhi suatu laju reaksi SN2
dan E2. Temperatur juga ikut mempengaruhi pada
reaksi bersaing SN2 dan E2. Naiknya suhu lebih akan berpengaruh pada
laju reaksi E2, hal ini dikarena pada reaksi E2 menggunakan energi aktivasi
yang lebih tingig dari SN2.
Dengan temperatur yang tinggi dapat memungkinkan molekul dapat lebih cepat
mencapai pada keadaan transisi eliminasi.
permasalahan :
1. mengapa pada
reaksi bersaing SN2 dan E2 menggunakan alkil halida primer dan basa kuat lebih
cenderung mengalami reaksi SN2?
2. apakah ada
kemungkinan untuk lebih dominan terjadinya reaksi E2 pada reaksi bersaing SN2
dan E2? jika da kemungkinan nya apa sajakah yang harus dilakukan agar reaksi E2
lebih dominan pada reaksi bersaing SN2 dan E2 ini ?
3. mengapa pada
reaksi bersaing SN2 dan E2 ketika menggunakan alkil halida tersier lebih
cendering terjadi reaksi E2 ?
Jumat, 13 Maret 2020
MEKANISME REAKSI BERSAING SN1 DAN E1
Mekansime
Reaksi Bersaing SN1 dan E1
Pada mekanisme reaksi SN1 dan E1 memiliki langkah pertama
yang sama – sama yakni pembentukan karbokation. Pada raeksi SN1, nukleofil
menyerang karbokation, membentuk produk substitusi. Pada mekanisme E1,
basis menghilangkan proton beta pada atom H yang membentuk ikatan baru dan pada
mekanisme reaksi E1 proses nya membutuhkan energi yang cukup besar.
Reaksi SN1
Tahapan
1. Pada tahap pertama yakni Proses ionisasi, pelepasan gugus pergi dari substart sehingga dapat menghasilkan karbokation Guguspergi disebut senyawa antara, dalam grafik energi sebagai titik tertinggi yang mampu bergerak maju sehingga menjadi produk ataupun berdegradasi menjadi substart.
Tahapan
1. Pada tahap pertama yakni Proses ionisasi, pelepasan gugus pergi dari substart sehingga dapat menghasilkan karbokation Guguspergi disebut senyawa antara, dalam grafik energi sebagai titik tertinggi yang mampu bergerak maju sehingga menjadi produk ataupun berdegradasi menjadi substart.
2. Penyerangan nukelofil, nukelofil menyerang karbokation
atau substrat sehingga terhibridisasi sp2 dan menghasilkan suatu produk
subtitusi
3. pada tahap terakhir yakni pelepasan proton
Reaksi E1
Tahapan
1.Tahap yang pertama yakni proses ionisasi, pada Proses ionisasi, pemisahan gugus pergi dari substart sehingga dapat menghasilkan karbokation sama seperti SN1
2.tahap terakhir yakni proses deprotonasi, pada proses
deprotonasi terjadi pemberian proton kepada basa lemah serta pembentukan ikatan
rangkap dua.
Dari kedua reaksi tersebut yakni reaksi SN1 dan E1 kecepatan
reaksi ditentukan melalui tahapan ionisasi yang membentuk suatu karbokation
yang lebih stabil. Yang mana reaksi SN1 Bereaksi lebih dominan dari pada reaksi
E1.Pada reaksi SN1 dan E1 keduanya menggunakan basa lemah sebagai nukleofilnya. pada
reaksi SN1 karakter pelarutnya itu seperti air dan alkohol. Sedangkan pada
reaksi E1 menggunakan pelarut polar yaitu seperti contohnya ion hidroksida.
Permasalahan :
1. mengapa reaksi SN1 berekasi lebih dominan dari pada
reaksi E1 ?
2. bagaimana kebutuhan energi dalam reaksi bersaing SN1
dan E1 ?
3. Apakah ada kemungkinan untuk reaksi E1 mendominasi
dari pada reaksi SN1 ? jika ada jelaskan upaya apa yang harus di lakukan agar reaksi
E1 mendominasi dari pada reaksi SN1
Senin, 09 Maret 2020
Jumat, 06 Maret 2020
MEKANISME REAKSI ELIMINASI : E1
MEKANISME REAKSI
ELIMINASI : E1
Reaksi E1
Karbokation dapat didefenisikan sebagai suatu zat antara yang tak stabil dan yang memiliki energi yang tinggi , dan bisa bereksi lebih lanjut. Sebagai salah satu cara karbokation mencapai suatu produk yang stabil adalah dengan berekasi dengan suatu nekleofil. Tentu saja ini berkaitan dengan reaksi SN1. Tetapi terdapat suatu alternatif yakni karbokation ini dapat membagikan suatu proton kepada suatu basa dalam suatu reaksi eliminasi, nah dalam hal ini reaksi E1 akan menghasilkan alkena.
Mekanisme reaksi E1
Ada dua tahap yang terjadi pada mekanisme reaksi E1.
Pada tahap pertama pada reaksi E1 identik dengn tahap pertama reaksi SN1 yakni ionisasi alkil halida. Tahap ini disebut juga dengan tahap lamabat , tahap ini juga menjadi tahap penentu laju dari reaksi keseluruhan . seperti reaksi SN1 , suatu reaksi E1 terdapat ke khasan menunjukkan kinetika order-pertama , dengan laju rekasi yang mana bergantung hanya pada konsentrasi alkil halinya ( substratnya ) saja. Karena hanya melibatkan satu pereaksi saja dalam keadaan transisi menjadi tahap penuntu laju reaksi , karena hal ini lah reaksi E1 disebutjuga dengan reaski unimolekul seperti reaksi SN1.
Pada tahap kedua pada reaksi E1 ini disebut juga dengan tahap cepat .Basa pada reaksi E1 itu merebut sebuah proton dari sebuah atom karbon terletak berdampingan dengan karbon positif dimana nanti nya karbon itu mengalami rehibridasi dari keadaan sp3 kekeadaan sp2 lalu terlebntuklah sebuah alkena
Permasalahan :
1. mengapa pada tahap kedua disebut juga dengan tahap cepat?
2. mengapa pada mekanisme reaksi E1 terdapat tahap lambat dan tahap cepat ?
3. mengapa pada tahap cepat karbon mengalami rehibridasi dari keadaaan sp3 ke keadaan sp2?