Kimia Organik II
Senin, 27 April 2020
Rabu, 15 April 2020
DERIVAT ASAM KARBOKSILAT
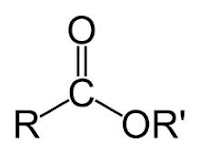
Derivat Asam Karboksilat
Derivat
asam karboksilat merupakan turunan darin asam karboksilat, yang mana dilihat dari
strukturnya suatu senyawa yang diperoleh oleh hasil dari pergantian gugus( –OH) dalam suatu rumus
struktur RCOOH dari gugus–OOCR , -OR, atau –NH2. Pada derivat asam
karboksilat akan lebih menjurus kepada amida , anhidrida asam, ester,nitril , dan halida asam. Segala turunan dari asam karboksilat memiliki gugus fungsi asil atau RCO- ataupun aroil ArCO- dan apabila dihidrolisis akan menghasilkan suatu asam karboksilat.
Oleh karena itu dengn adanya gugs karbonik dapat menyebabkn turunan asam karboksilat itu
bersifat polar, lalu kepolaran ini yang akan berpengaruh dengan sifat-sifat yang ada dalam turunan asam karboksilat
A. Kereaktifan Derivat Asam Karboksilat
Derivat asam
karboksilat merupakan senywa yang menghsilkan suatu asam karboksilat mengalamiihidrolisis. Tidak sepertiketon dan aldehida, turunan dari asam krboksilat
akan mengandng gigus yang tinggal. Perlu para chem's diketahui
bahwa seluruh derivat mengandung gugus asil (RCO-), kecuali nitril.Pada derivat
asam karboksilat ,
sedangkan senyawa keton dan aldehida tidakmempunyai gugus pergi yang terikat dengan karbon asil.
B. Sifat Spektral Derivat Asam Karboksilat
Spektra
nomor dari derivat asam karboksilat dapat memberikan kita sedikit informasi tentang
fungsionalitas jka dibadingkan dengan spektra inframerah yang memberikan kita
banyak informasi tentang tipe gugus fungsional.
1* Klorida asam
Absorpsi
inframerah pada karbonil dari klorida asam ditemukan pada frekuensi nya sedikit
lebih tinggi daripada respan untuk derivat asam yang lain.
3* Ester
Absorpsi
inframerah pada karbonil daru ester alifatik berkisar 1740 cm-1 atau berkisar 5,75 mm, akan tetapi ester dapat terkonjugasi menyerap pada frekuensi
sedikit rendah.
4*Amida
Resapan gugus karbonil pada suatu amida memiliki posisi yang beranekaragam dan ini tergantung oleh sejauh
mana ikatan hidrogen dengan molekul-molekul. Spektrum inframerah oleh suatu
amida cair murni akan menunjukkan suatu peak yang biasa disebut pita amida I.
5*Nitril
Resapan CºN dijumpai pada daerah ikatan rangkap 3 dari
spektrum inframerh dan dalam intensitas dari medium ke lemah.
C. Turunan dari Asam Karboksilat
Terdapat banyak sekali senyawa turunan dari asam karboksilat.
Beberapa yang akan saya bahasdi antaranya adalah halida asam,amida, ester,anhidrida asam , dan nitril.
Berikut penjelasan nya :
Halida asam merupakan salah satu senyawa turunan oleh asam molekul R(C=O)X.pada penaman nyahalida asam sangatlah sederhana, yaitu karboksilat oleh rumus dengan
menuliskan nama halida sehabs gugus alkil. Sebagai salah satu contoh halida asam
adalah asetil klorida dengan rumus struktur CH3COCI.
Anhidrida asam merupakan salah satu senyawa turunan dari asam karbksilat yang
memiliki gugus asil (RC=0) yang terikat pada oksigen sebagai pengganti hidrogen.
Rumus umum dari anhidrida asam yakni ([RC=O]O[O=CR]). Pada tata nama anhidrida asam yaitu dengan mengubah kata asam menjadi anhidrida. Contoh salah satu dari anhidrida adalah
anhidrida asetat yang memiliki rumus (CH3CO-O-OCCH3)
Ester adalah salah satu turunan senyawa dari asam karboksilat yang hidrogennya pada
gugus karboksil akan diganti menjadi gugs alkil. Ester adalah senyawa yang dikenal memiliki aroma yang harum dan menyenangkan. Ester banyak terdapat pada
buah dan bunga. Sebagai contoh, isoamil asetat banyak ditemukan pada buah
pisang. sehingga ester banyak digunakan untuk bahan pembuatan parfum .Ester sering juga disebut dengan alkil alkanoat. Tata nama ester yakni
dengan menuliskan gugus alkil diringi dengan gugus asil dan diakhiri dengan -at.
Kereaktifan asam karboksilat terhadap esterifikasi : HCOOH
> CH3COOH > RCH2COOH > R2CHCOOH > R3CCOOH
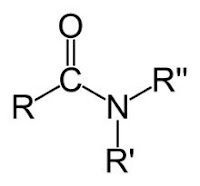
Amida merupakan senyawa turunan dari asam karboksilat yang memiliki gugus
amino (-NH2) yang terikat pada karboksil sebagai pengganti dari atom hidrogen.pada penamaan amida yakni dengan menghapus kata asam, dan pada akhiran -oat digait
dengan kata -amida. Contoh dari amida yakni etanamida yang memiliki rumus struktur CH3CONH2.
Nitril merupakan senyawa turunan dari asam karboksilat yang mempunyai ikatan rangkap tiga C
dengan atom N. Rumus umum nitril yakni RC=N. Nitril dikenal dengan senyawa yang beracun. Penamaan senyawa nitril yakni dengan menambahkan kata akhiran
-nitril sehabis nama alkana.
Permasalahan :
1.mengapa turunan asam karboksilat mengandung gugus yang
tinggal ?padahal senyawa aldehid dan keton tidak dan jika di tinjau ketiga nya
hampir mirip
2.mengapa spektra inframerah memberikan informasi lebih
banyak dibanding spektra nomor dari derivat asam karboksilat ?
3. Pada Kereaktifan asam karboksilat terhadap esterifikasi
mengapa HCOOH memiliki kereaktifan
terbesar dibanding CH3COOH ?
Senin, 13 April 2020
PEMBENTUKAN DAN SIFAT-SIFAT ASAM KARBOKSILAT
ASAM KARBOKSILAT
Asam karboksilat merupakan
asam organik yang memiliki kekhasan pada gugus karboksil. Asam
karboksilat termasuk asam Bronsted-Lowry
(donor proton). Garam dan anion asam karboksilat disebutn karboksilat. Asam
karboksilat termasuk senyawa polar, serta membentuk ikatan hidrogen satu dengan
lainnya. Asam karboksilat berbentuk dimer Pada fasa gas. Asam karboksilat suatu asam lemah yang mana sebagian molekulnya
akan terdisosiasi menjadi H+ dan RCOO-. Sebagai
Contoh : pada suhu kamar, hanya 0,02% molekul asam asetat yang dapat terdisosiasi dalam air. Asam karboksilat
alifatik rantai pendek (atom karbon <18) ini dibuat menggunakan karbonilasi
alkohol dengan karbon monoksida. Untuk rantai panjang dibuat dengan hidrolisis
trigliserida yang biasa terdapat pada minyak hewan dan tumbuhan.
Terdapat ciri khusus pada
asam karboksilat yakni terdapatnya gugus fungsi karboksil (-COOH), karboksil
diperoleh dari karbonil (-CO-) dan hidroksil (-OH).
Sifat Fisik Asam karboksilat
-
Asam karboksilat memiliki titik didih
lebih tinggi dibandingkan senyawa organik golongan lain yang massa molekulnya
sebanding.
-
Kelarutan asam karboksilat pada H2O lebih
besar daripada eter, keton, aldehida,
dan alkohol yang massa molekulnya sebanding.
-
Kelarutan asam karboksilat pada air akan
menurun seiring dengan meningkatnya berat molekul.
-
Asam karboksilat yang memiliki 1-4 atom
karbon bisa larut sempurna dalam air.
Sifat KimiaAsam karboksilat
-
Reaksi dengan basa
Asam karboksilat dapat bereaksi dengan basa menghasilkan garam dan air.
Contoh :
Asam karboksilat dapat bereaksi dengan basa menghasilkan garam dan air.
Contoh :
-
Reduksi
Reduksi asam karboksilat dengan menggunakan katalis (LiAl4) menghasilkan alkohol primer.
Contoh :
Reduksi asam karboksilat dengan menggunakan katalis (LiAl4) menghasilkan alkohol primer.
Contoh :
-
Reaksi dengan tionil
diklorida
Asam karboksilat direaksikan dengan tionil diklorida akan membentuk klorida asam, hidrogen klorida + gas belerang dioksida.
Contoh :
Asam karboksilat direaksikan dengan tionil diklorida akan membentuk klorida asam, hidrogen klorida + gas belerang dioksida.
Contoh :
-
Esterifikasi
asam karboksilat direaksikan dengan alkohol membentuk ester. Reaksi yang akan terjadi merupakan reaksi kesetimbangan.
Contoh :
asam karboksilat direaksikan dengan alkohol membentuk ester. Reaksi yang akan terjadi merupakan reaksi kesetimbangan.
Contoh :
-
Reaksi dengan amonia
asam karboksilat direaksikan dengan amonia, akan membentuk amida dan air.
Contoh :
asam karboksilat direaksikan dengan amonia, akan membentuk amida dan air.
Contoh :
-
Dekarboksilasi
Pada suhu tinggi, asam karboksilat akan terdekarboksilasi membentuk senyawa alkana.
Contoh :
Pada suhu tinggi, asam karboksilat akan terdekarboksilasi membentuk senyawa alkana.
Contoh :
-
Halogenasi
Asam karboksilat dapat bereaksi dengan halogen menggunakan katalis phosfor akanmembentuk asam trihalida karboksilat + hidrogen halida.
Contoh :
Asam karboksilat dapat bereaksi dengan halogen menggunakan katalis phosfor akanmembentuk asam trihalida karboksilat + hidrogen halida.
Contoh :
Pembuatan Asam karboksilat
-
Oksidasi alkohol
primer
Oksidasi alkohol primer dengan menggunakan katalis (KMnO4) akan menghasilkan asam karboksilat.
Contoh :
Oksidasi alkohol primer dengan menggunakan katalis (KMnO4) akan menghasilkan asam karboksilat.
Contoh :
- Karbonasi pereaksi
Grignard
Karbonasi menggunakan pereaksi Grignard dalam eter, selanjutnya dihidrolisis akan menghasilkan produk asam karboksilat.
Contoh :
Karbonasi menggunakan pereaksi Grignard dalam eter, selanjutnya dihidrolisis akan menghasilkan produk asam karboksilat.
Contoh :
-
Oksidasi alkil benzena
Oksidasi alkil benzena dngan menggunakan katalis kalium bikromat + asam sulfat akan menghasilkan senyawa asam karboksilat.
Contoh :
Oksidasi alkil benzena dngan menggunakan katalis kalium bikromat + asam sulfat akan menghasilkan senyawa asam karboksilat.
Contoh :
-
Hidrolisis senyawa
nitril
Hidrolisis senyawa nitril pada suasana asam akan membentuk suatu enyawa asam karboksilat.
Contoh :
Hidrolisis senyawa nitril pada suasana asam akan membentuk suatu enyawa asam karboksilat.
Contoh :
Permasalahan :
1. Pada suhu tinggi , asam karboksilat terdekarboksilasi membentuk alkana. Apa yang menyebabkan suhu yang tinggi dapat membuat asam karboksilat terdekarboksilasi membentuk alkana?
2.Oksidasi alkil benzena dengan katalis kalium bikromat dan asam sulfat akan menghasilkan asam karboksilat.apakah ada katalis lain yang dapat membentuk asam karboksilat pada Oksidasi alkil benzena selain menggunakan katalis kalium bikromat dan asam sulfat?
3.mengapa kelarutan asam karboksilat dalam air lebih besar daripada alkohol, eter, aldehida, dan keton padahal ketika di perhatikan berat molekulnya sama?
Jumat, 10 April 2020
MEKANISME REAKSI REDUKSI PADA BERBAGAI SENYAWA ORGANIK
MEKANISME
REAKSI REDUKSI PADA BERBAGAI SENYAWA ORGANIK
Pada blog saya sebelum nya saya telah membahs
mengenai reaksi oksidasi pada alkohol nah sekarang tak lengkap bila telah
membahas oksidasi namun tidak membahas reduksi. Pada blog sya kali ini saya
akan membahas mengenai mekanisme reaksi reduksi pada berbagai senyawa organik. Yang
mana perlu kita ketahui terlebih dahulu makna dari reaksi reduksi , Reaksi reduksi yakni suatu jenis reaksi
dalam kimia organik yang mana terjadi penurunan suatu bilangan oksidasi melalui
penangkapan elektron ataupun pelepasan oksigen pada suatu molekul, atom, maupun
ion.
Nah kali ini saya akan
membahsa mengenai mekanisme reaksi reduksi pada aldehid dan keton
Reduksi Aldehida dan
Keton menggunakan NaBH4 atau LiAlH4
Pada reaksi reduksi ini aldehida akan di ubah
menjadi alkohol primer, dan keton akan menjadi alkohol sekunder, melalui
perlakuan dengan NaBH4 (natrium borohidrida) atau LiAlH4 (litium aluminium
hidrida).Mari kita perhatikan walaupun reaksi ini mencapai hasil keseluruhan
yang sama, pada kondisi untuk reaksi agak sedikit berbeda.
Mekanisme reaksi reduksi yang terjadi pada
aldehid dan keton
·
akan terjadi serangan nukleofilik ion hidrida pada suatu karbon karbonil
elektrofilik
·
Adanya protonasi oleh alkoksida yang dihasilkan oleh air ataupun asam
lainnya. Alkoksida adalah oksi bermuatan negatif, karena mereka merupakan
alkohol yang dideprotonasi
Pada tahap terakhir ini dapat terjadi
dengan media yang sama pada langkah pertama, ataupun sumber proton dapat
ditambahkan kemdian.
Pada pandangan lain dari literatur yang
berbeda :
Adanya penyerangan hidrida logam sebagai
contoh NaBH 4 dan LiAlH 4 yakni dengan cara mentransfer satu ekuivalen hidrida
(H - ) kepada ikatan rangkap C = O. Lalu selanjutnya keton akan direduksi
menjadi alkohol berikut ini:
Gambar dibawah yakni menggunakan reagent
NaBH4
Gambar dibawah ini yakni menggunakan
reagent LiAlH 4
Karena reaktivitas LiAlH4 yang sangat tinggi, ia
bereaksi dengan cepat dan secara exoergik dengan pelarut protik. Jika LiAlH4 ditambahkan ke air atau pelarut
alkohol, pembentukan H2 (g) sangat cepat dan cenderung menyebabkan
kebakaran. Sebaliknya, NaBH4 bereaksi
dengan pelarut ini cukup lambat sehingga konsumsi hidrida dan evolusi gas
hidrogen dapat diabaikan.
Agar reaksi
terjadi pada kecepatan yang masuk akal, pereaksi dan reaktan keduanya harus
larut dalam pelarut reaksi, setidaknya sampai batas tertentu. Baik LiAlH4 dan NaBH4 adalah bahan ionik,
yang berarti bahwa mereka hanya akan larut dalam pelarut yang relatif
polar. Tetapi di sinilah perbedaan
reaktivitas menjadi penting, karena banyak pelarut polar akan bereaksi dengan
reagen hidrida. Jelas, pelarut yang
mengandung karbonil seperti aseton tidak dapat digunakan karena akan berkurang
juga. Pelarut harus dipilih agar sesuai
dengan reagen tertentu yang kita gunakan.
Pada keton yang mengalami reduksi dapat
menghasilkan atau menjadi suatu produk alkohol sekunder , hidrokarbon , ataupun
suatu amina . produk yang dihasilkan itu tergantung pada bahan pereduksi dan pada
suatu struktur senyawanya.
Permasalahan :
2. pada keadaan yang bagaimana ketika suatu keton di reduksi tidak menghasilkan produk alkohol sekunder ?
3. Apa yang menyebabkan LiAlH4 reaktivitas nya lebih tinggi daripada NaBH4 ?
Langganan:
Komentar (Atom)
-
Mekanisme Reaksi Substitusi Nukleofilik S N 2 Reaksi Substitusi merupakan mengganti satu gugus atom atau pun molekul dengan atom at...
-
MEKANISME REAKSI-REAKSI ADISI ALDEHID DAN KETON Gugus karbonil merupakan gugus terpenting dalam kimia organik. Hampir setiap proses ...
-
MEKANISME REAKSI BERSAING SN2 DAN E2 Minggu lalu saya telah membahas mengenai mekanisme reaksi bersaing SN1 dan E1 ada baik jika materi...